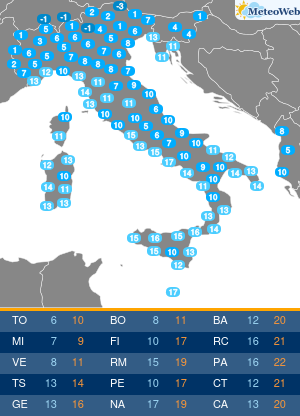
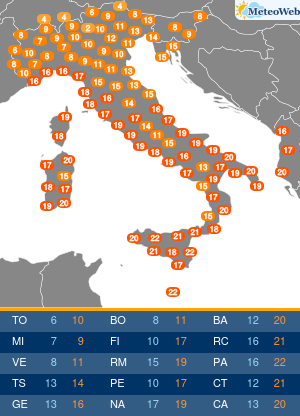
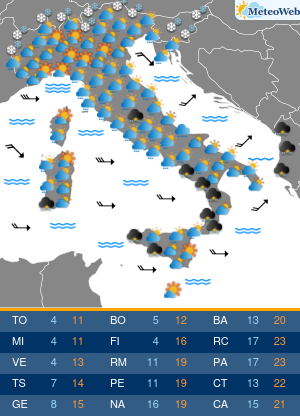
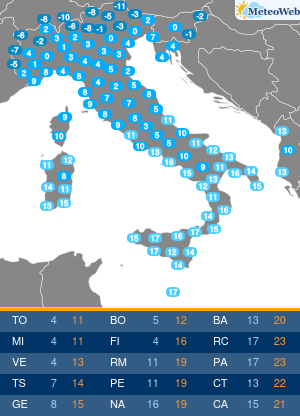
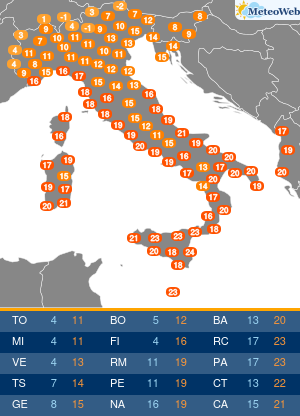
 I pazienti affetti da Epatite C (HCV) hanno da oggi un’arma in piu’ per combattere la malattia. E’ stato infatti approvato anche in Italia il nuovo trattamento: Sofosbuvir (Determina n. 1353/2014 del 12 novembre 2014 pubblicata in Gazzetta Ufficiale Serie Generale n.283 il 5 dicembre 2014), sviluppato da Gilead Sciences, che rappresenta una nuova frontiera nella cura dell’epatite C, infezione che, se non trattata, puo’ portare a cirrosi epatica, insufficienza epatica e cancro al fegato, con un impatto significativo su mortalita’ e morbilita’ individuali e collettive. Sofosbuvir e’ il primo inibitore nucleotidico della polimerasi con attivita’ pan-genotipica. E’ un farmaco orale che puo’ essere utilizzato secondo diversi schemi di trattamento: per 12 settimane in associazione a ribavirina (RBV), con o senza interferone pegilato (peg-IFN); oppure in associazione a ribavirina per 24 o 48 settimane (o fino al trapianto di fegato). “L’impatto di Sofosbuvir e’ rivoluzionario. – afferma il Prof. Mario Rizzetto, Docente di Gastroenterologia presso l’Universita’ di Torino, Direttore della Struttura Complessa S.C Gastroenterologia U, Azienda Ospedaliera Citta’ della Salute e della Scienza di Torino – Considerata la sua elevata efficacia e sicurezza, il farmaco consentira’ di curare la maggioranza dei pazienti con epatite cronica C, eradicando il virus anche nelle forme avanzate che portano al trapianto, evitando la temuta reinfezione dell’innesto epatico che vanifica troppo spesso il successo del trapianto stesso”. Si stima che in Italia circa 1,5 milioni di persone siano cronicamente infette da epatite C (HCV), ma solo poco piu’ di 300.000 casi sono stati diagnosticati. Di questi, si stima che i pazienti con malattia epatica piu’ grave siano circa 50.000. L’HCV e’ una delle principali cause di cancro al fegato e di trapianto di fegato, per entrambi i quali l’Italia detiene il record europeo. In Italia la mortalita’ causata da HCV e’ pari a circa 10.000 casi all’anno. L’autorizzazione all’immissione in commercio di Sofosbuvir – rilasciata il 16 gennaio 2014 – e’ supportata principalmente dai dati relativi a cinque studi di Fase 3, nell’ambito dei quali la terapia a base di Sofosbuvir della durata di 12 o 16 settimane si e’ dimostrata superiore, o non inferiore, alle attuali opzioni di trattamento con ribavirina (RBV)/interferone pegilato (peg-IFN), sulla base della percentuale di pazienti che hanno avuto una risposta virologica sostenuta 12 settimane dopo il completamento della terapia. “L’introduzione di Sofosbuvir nel nostro Paese rappresenta un enorme passo avanti; tra l’altro, sono in via di sviluppo altri nuovi farmaci antivirali che, combinati con Sofosbuvir, permetteranno di adattare individualmente i regimi terapeutici a una vasta gamma di pazienti. – precisa Rizzetto -Nell’attesa delle risorse aggiuntive necessarie a garantire un accesso universale alla terapia, l’Agenzia Italiana del Farmaco ha indicato i criteri di priorita’ di assegnazione della cura per i pazienti con patologia piu’ grave”.
I pazienti affetti da Epatite C (HCV) hanno da oggi un’arma in piu’ per combattere la malattia. E’ stato infatti approvato anche in Italia il nuovo trattamento: Sofosbuvir (Determina n. 1353/2014 del 12 novembre 2014 pubblicata in Gazzetta Ufficiale Serie Generale n.283 il 5 dicembre 2014), sviluppato da Gilead Sciences, che rappresenta una nuova frontiera nella cura dell’epatite C, infezione che, se non trattata, puo’ portare a cirrosi epatica, insufficienza epatica e cancro al fegato, con un impatto significativo su mortalita’ e morbilita’ individuali e collettive. Sofosbuvir e’ il primo inibitore nucleotidico della polimerasi con attivita’ pan-genotipica. E’ un farmaco orale che puo’ essere utilizzato secondo diversi schemi di trattamento: per 12 settimane in associazione a ribavirina (RBV), con o senza interferone pegilato (peg-IFN); oppure in associazione a ribavirina per 24 o 48 settimane (o fino al trapianto di fegato). “L’impatto di Sofosbuvir e’ rivoluzionario. – afferma il Prof. Mario Rizzetto, Docente di Gastroenterologia presso l’Universita’ di Torino, Direttore della Struttura Complessa S.C Gastroenterologia U, Azienda Ospedaliera Citta’ della Salute e della Scienza di Torino – Considerata la sua elevata efficacia e sicurezza, il farmaco consentira’ di curare la maggioranza dei pazienti con epatite cronica C, eradicando il virus anche nelle forme avanzate che portano al trapianto, evitando la temuta reinfezione dell’innesto epatico che vanifica troppo spesso il successo del trapianto stesso”. Si stima che in Italia circa 1,5 milioni di persone siano cronicamente infette da epatite C (HCV), ma solo poco piu’ di 300.000 casi sono stati diagnosticati. Di questi, si stima che i pazienti con malattia epatica piu’ grave siano circa 50.000. L’HCV e’ una delle principali cause di cancro al fegato e di trapianto di fegato, per entrambi i quali l’Italia detiene il record europeo. In Italia la mortalita’ causata da HCV e’ pari a circa 10.000 casi all’anno. L’autorizzazione all’immissione in commercio di Sofosbuvir – rilasciata il 16 gennaio 2014 – e’ supportata principalmente dai dati relativi a cinque studi di Fase 3, nell’ambito dei quali la terapia a base di Sofosbuvir della durata di 12 o 16 settimane si e’ dimostrata superiore, o non inferiore, alle attuali opzioni di trattamento con ribavirina (RBV)/interferone pegilato (peg-IFN), sulla base della percentuale di pazienti che hanno avuto una risposta virologica sostenuta 12 settimane dopo il completamento della terapia. “L’introduzione di Sofosbuvir nel nostro Paese rappresenta un enorme passo avanti; tra l’altro, sono in via di sviluppo altri nuovi farmaci antivirali che, combinati con Sofosbuvir, permetteranno di adattare individualmente i regimi terapeutici a una vasta gamma di pazienti. – precisa Rizzetto -Nell’attesa delle risorse aggiuntive necessarie a garantire un accesso universale alla terapia, l’Agenzia Italiana del Farmaco ha indicato i criteri di priorita’ di assegnazione della cura per i pazienti con patologia piu’ grave”.
Salute, epatite C: in Italia il superfarmaco che eradica il virus