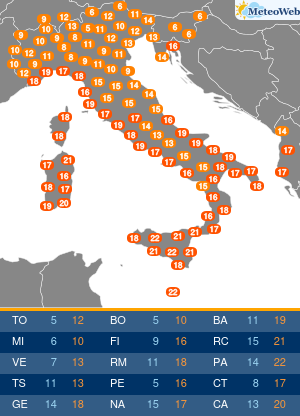
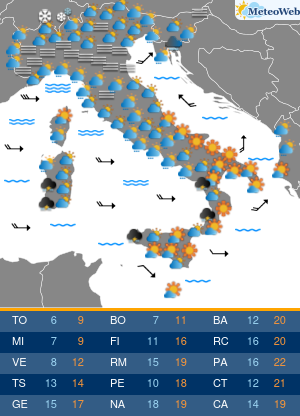
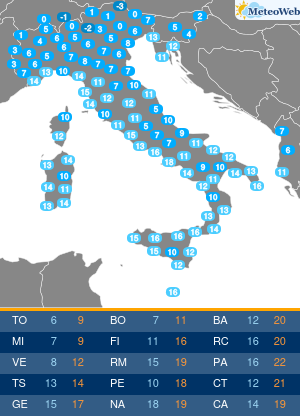
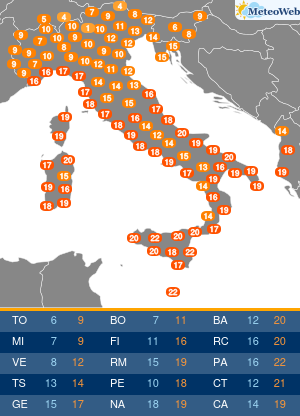
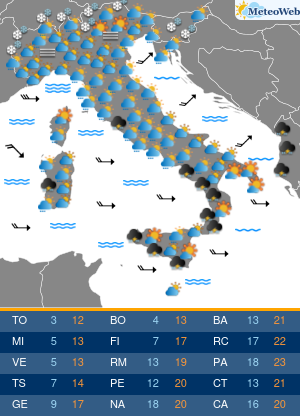
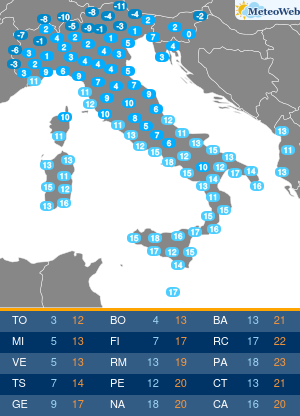
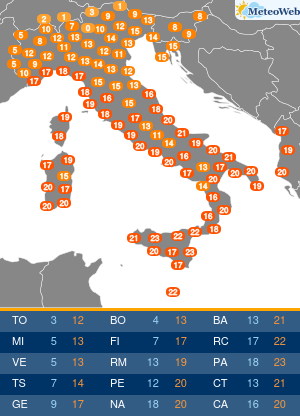
Non tutte le mutazioni Brca1 e Brca2 aumentano allo stesso modo la probabilità di ammalarsi di cancro al seno e alle ovaie. Lo svela un nuovo studio condotto sui ‘geni di Angelina’, i difetti del Dna che hanno portato la Jolie a optare per l’asportazione di entrambi gli organi, considerato il profilo genetico ad alto rischio e le morti per tumore fra le donne della sua famiglia. Una decisione rilanciata in prima pagina dai media di tutto il mondo, che ha riacceso i riflettori sulla chirurgia preventiva suscitando l’interesse e le domande dell’universo femminile. Se i geni Brca1 e 2 sono mutati bisogna fare come lei? Sempre? E solo per il seno o anche per le ovaie? La nuova ricerca – pubblicata su ‘Jama’ e condotta dagli scienziati del Basser Center for Brca dell’Abramson Cancer Center, presso la Perelman School of Medicine dell’università della Pennsylvania – sembra suggerire, in caso di mutazione ai geni Brca, la necessità di indagini mirate sul tipo di difetto per poi valutare interventi personalizzati. In altre parole, il pericolo di ammalarsi e quindi la strada da seguire per evitarlo potrebbe non essere la stessa per tutti. Lo studio ha coinvolto oltre 31 mila donne con mutazioni ai geni Brca1 e Brca2, indicando che alcune variazioni conferiscono un rischio più alto di cancro al seno, mentre altre moltiplicano le chance di sviluppare un tumore ovarico. “Sono stati fatti grandi progressi nel capire come ridurre il rischio di cancro associato alle mutazioni ereditarie nei geni Brca1 e Brca 2 – sottolinea Timothy R. Rebbeck, professore di epidemiologa e direttore associato di scienza di popolazione all’Abramson Cancer Center – Ma finora si sapeva poco su quanto il pericolo di ammalarsi variasse a seconda della specifica mutazione ereditata. I risultati di questo studio sono un primo passo verso la comprensione di come personalizzare la definizione del rischio per adottare la strategia preventiva più adatta alla singola paziente”. Rebbeck e colleghi hanno valutato le diagnosi di cancro relative a 19.581 donne portatrici di mutazioni del gene Brca1 e 11.900 con variazioni al Brca2. Quindi hanno analizzato se il tipo o la localizzazione delle singole mutazioni fosse correlata alla probabilità di tumori mammari oppure ovarici. Gli scienziati hanno così identificato su entrambi i geni regioni che, se ‘difettose’, comportano un maggior rischio di cancro al seno, mentre altre che risultano associate più specificamente a un aumentato pericolo di tumore alle ovaie. Qualche esempio. In precedenza si riteneva che una donna con mutazione del gene Brca1 avesse il 59% di probabilità in più di ammalarsi di cancro al seno entro i 70 anni, e il 34% di rischio in più per le ovaie. La nuova ricerca suggerisce invece che le donne con un tipo particolare di mutazioni del corredo genetico Brca, diffuse soprattutto fra gli ebrei ashkenaziti, hanno una probabilità di cancro al seno del 69% superiore e un pericolo di tumore ovarico del 26% inferiore. Ma ora la questione è: queste differenze possono influenzare concretamente la decisione di una donna in merito alla strategia preventiva da adottare, se chirurgica o di sorveglianza attiva con controlli costanti ad hoc? “Grazie ai nuovi dati sappiamo di più sul rischio mutazione-specifico e questo potrebbe offrire informazioni importanti per la valutazione delle donne portatrici – risponde Katherine L. Nathanson, autore seniore dello studio, professore associato di medicina e direttore di genetica all’Abramson Cancer Center – Adesso sono però necessarie ulteriori ricerche per determinare il rischio assoluto associato alle diverse mutazioni dei geni Brca1 e Brca2, e per capire come queste differenze potrebbero influenzare le decisioni delle pazienti”. I lavori sono in corso e forse cambieranno la vita alle ‘Jolie’ del futuro.