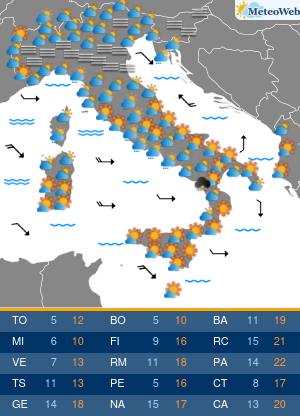
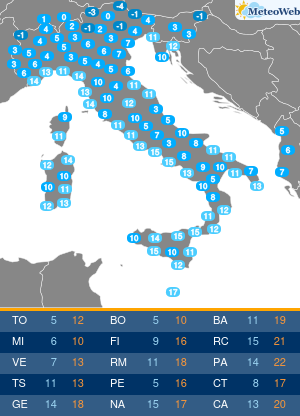
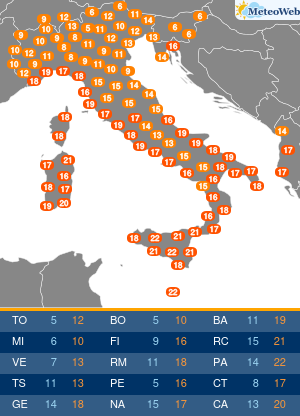
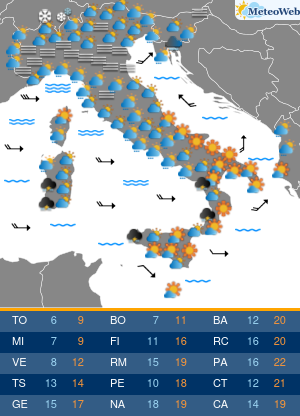
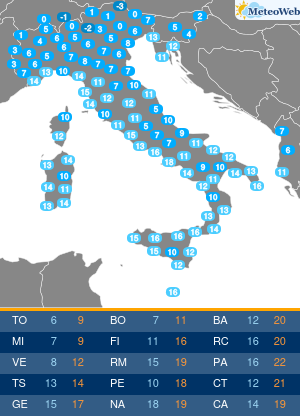
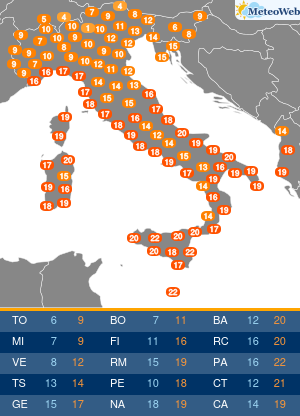
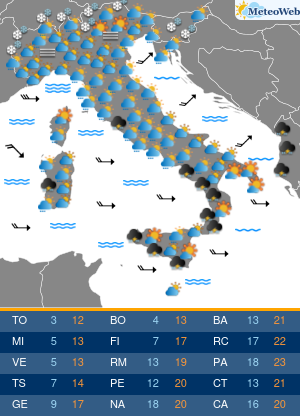
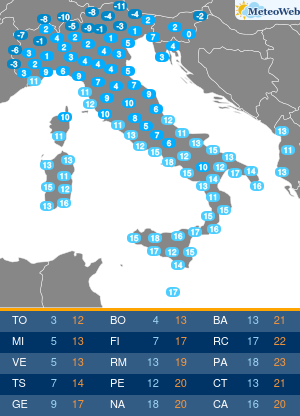
Moderna ha presentato alla Food and Drug Administration (FDA) statunitense la richiesta per l’autorizzazione di emergenza alla somministrazione della quarta dose del suo vaccino contro il Covid-19.
La richiesta interessa l’intera popolazione adulta degli Stati Uniti, anziché i soli soggetti di età superiore a 65 anni, ed è quindi più ampia rispetto alla richiesta di Pfizer avanzata all’inizio di questa settimana.
Secondo una nota di Moderna, il via libera alla quarta dose consentirebbe ai Centri per la prevenzione e il controllo delle malattie (CDC) una maggiore “flessibilità” nella definizione delle misure per il contenimento della pandemia, e ai fornitori di servizi sanitari stabilire “l’uso appropriato” di una seconda dose di richiamo del vaccino mRNA, “anche per quelli a più alto rischio di COVID-19 a causa dell’età o di comorbidità“.
Moderna ha affermato che la sua richiesta di una dose aggiuntiva si basa in parte su “dati pubblicati di recente generati negli Stati Uniti e in Israele in seguito all’emergere di Omicron“.
Martedì scorso, Pfizer-BioNTech ha chiesto alle autorità di regolamentazione statunitensi di autorizzare una dose aggiuntiva di richiamo del loro vaccino per gli anziani, affermando che i dati provenienti da Israele suggeriscono che gli anziani ne trarrebbero beneficio.