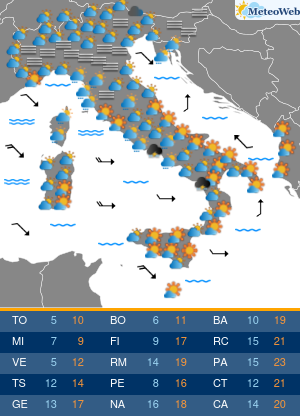
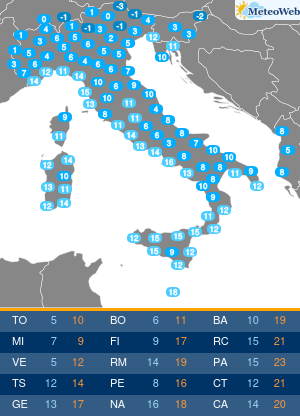
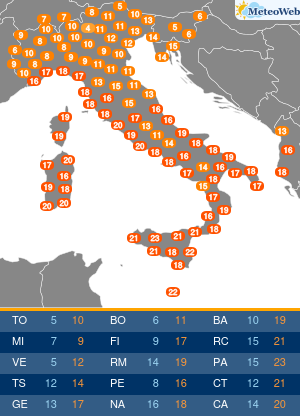
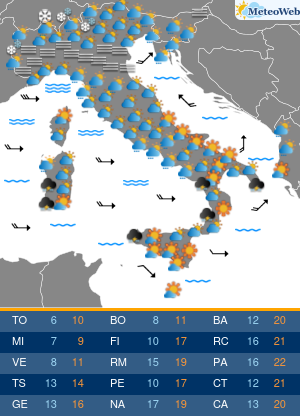
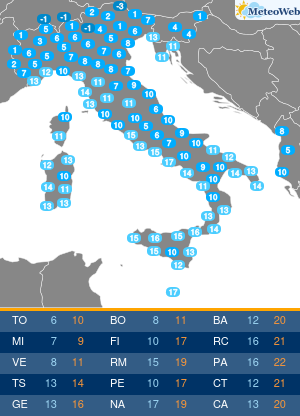
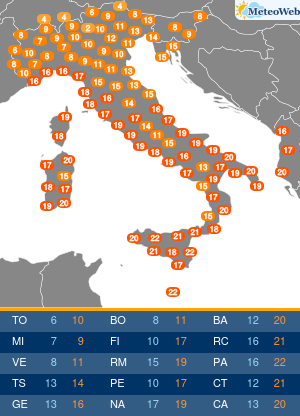
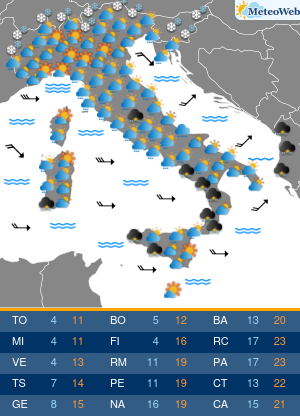
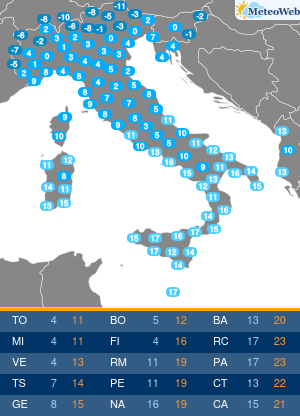
Anche se l’Organizzazione mondiale della sanità (Oms) ha dichiarato la fine di COVID come emergenza di sanità pubblica di interesse internazionale (Pheic), il virus Sars-CoV-2 “rimane” e “vaccini e antivirali continueranno a essere strumenti necessari per contenerne l’impatto nei soggetti più a rischio”. Come saranno allora i prossimi vaccini anti-COVID? L’Agenzia europea del farmaco Ema è al lavoro su questo fronte, assicura all’Adnkronos Salute Marco Cavaleri, responsabile della strategia per le minacce sanitarie e i vaccini dell’ente regolatorio Ue, e un’indicazione verrà messa nero su bianco entro giugno. “Anche noi stiamo valutando come cambiare la composizione dei vaccini COVID per il prossimo autunno”, spiega.
Così come lo sta facendo Oltreoceano la statunitense Food and Drug Administration (Fda), che ha annunciato per il 15 giugno la calendarizzazione di una riunione del suo Comitato consultivo sui vaccini e sui prodotti biologici correlati per discutere e formulare raccomandazioni sulla selezione dei ceppi da includere nei vaccini COVID aggiornati periodicamente per il 2023-2024. Cavaleri riepiloga le tappe che ora si prospettano: “La settimana prossima ci sarà un meeting di diverse agenzie regolatorie, e con l’Oms, per decidere in che direzione andare con gli aggiornamenti. Poi l’Ema esprimerà un parere che sia allineato per quanto possibile con Fda. I tempi saranno da qui a giugno”. I vaccini COVID “verranno verosimilmente aggiornati in linea con le varianti in circolazione al momento, che tendono ad evadere la risposta anticorpale prodotta da i vaccini di uso corrente, inclusi i bivalenti”.
A proposito di bivalenti, sempre negli Usa la Fda ha apportato di recente alcune modifiche alle autorizzazioni all’uso di emergenza (Eua) dei vaccini a mRna bivalenti di Moderna e Pfizer-BioNTech, e ha comunicato che gli over 65 che hanno ricevuto una singola dose di un vaccino anti-COVID bivalente possono riceverne una seconda se sono passati almeno 4 mesi. L’ulteriore booster è possibile anche per la maggior parte delle persone immunocompromesse, a distanza di almeno 2 mesi dal precedente richiamo bivalente fatto, ha aggiunto la Fda, e possono essere somministrate dosi aggiuntive a discrezione e a intervalli determinati dal proprio medico. In Europa, spiega Cavaleri, “i vaccini bivalenti possono essere usati come ulteriore dose se necessario. Questo era già possibile sin dalla autorizzazione iniziale a settembre dell’anno scorso”, conclude.