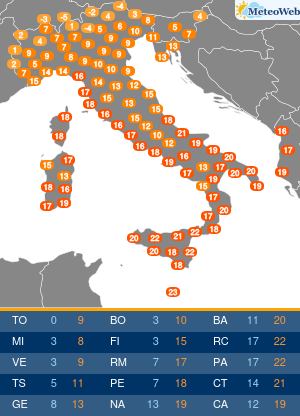
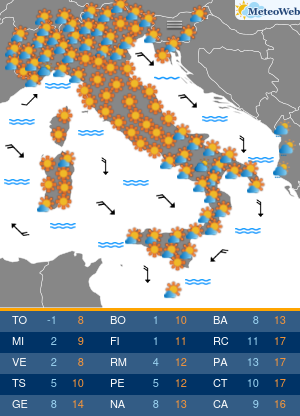
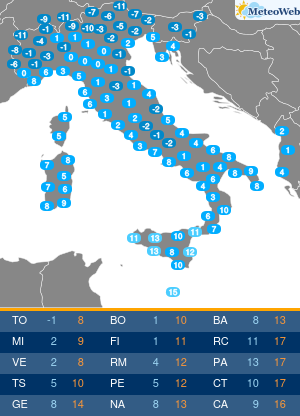
Nella vita di ciascuno di noi una serie di agenti esterni come stress, inquinamento, alimentazione sbagliata hanno un impatto sul nostro organismo che possono alterare addirittura il DNA. Questi cambiamenti al DNA dovuti dalle sostanze inquinanti influenzano l’accensione o lo spegnimento di alcuni geni piuttosto che altri che sono il terreno fertile anche per malattie cardiovascolari.
Possiamo tutelarci da questi agenti esterni tramite la conservazione del DNA alla nascita per salvaguardare il nostro patrimonio biologico. Il DNA fetale si presenta puro nella sua struttura originaria e senza tutte le modifiche che nel tempo si accumulano. Il DNA puro costituisce un punto di partenza fondamentale per analisi genetiche comparative utili a comprendere i cambiamenti che ha subito il nostro DNA durante la vita.
Perché conservare il DNA umano
Il DNA prelevato alla nascita o entro i primi sei mesi, attraverso un campione salivare, permette di studiare i mutamenti genetici, scoprire la storia genetica e poter dunque agire in modo mirato in caso di necessità. L’analisi comparativa del DNA permette in caso di malattie una comparazione con lo stato attuale del DNA indentificando nel dettaglio dove ci sono stati dei mutamenti per poter agire di conseguenza in modo mirato con un piano terapeutico adatto.
Il DNA trova inoltre impiego anche in quella che viene definita “medicina di precisione”, usando le informazioni che si possono trarre dal corredo genetico di una persona per formulare terapie paziente-dipendenti. In un prossimo futuro, usando questo tipo di analisi comparativa a livello genetica, i soggetti potranno scegliere farmaci ad hoc e le relative dosi personalizzate a seconda del paziente ottenendo dunque maggiori risultati terapeutici.
Uno dei casi più comuni riguarda la resistenza agli antibiotici che secondo i dati dell’Istituto Superiore di Sanità, potrebbe causare la morte di 10 milioni di persone all’anno entro il 2050 rendendolo così un vero problema urgente che richiede un intervento globale.
La medicina di precisione
“Le indagini per l’individuazione del farmaco adatto vengono effettuate ad esempio su persone infette dal virus dell’immunodeficienza umana (HIV). – ha spiegato la Dott.ssa Stefania Fumarola, biologa e responsabile scientifica di In Scientia Fides – Prima di prescrivere il farmaco antivirale abacavir (Ziagen), i medici testano regolarmente i pazienti con infezione da HIV per una variante genetica che li rende più propensi ad avere una reazione negativa al farmaco. Un altro esempio è il farmaco per il cancro al seno trastuzumab (Herceptin) o anche per la leucemia linfoblastica acuta, in questi casi la Food and Drug Administration (FDA) statunitense raccomanda test genetici prima di somministrare il farmaco chemioterapico mercaptopurina (Purinethol)”.
La FDA consiglia inoltre ai medici di testare i pazienti affetti da cancro del colon per alcune varianti genetiche prima di somministrare irinotecan (Camptosar), che fa parte di un regime chemioterapico combinato.
Le prospettive future
“Gli studi hanno scoperto che i farmaci chemioterapici, gefitinib (Iressa) ed erlotinib (Tarceva), – conclude la Dott.ssa Fumarola – funzionano molto meglio nei pazienti con cancro ai polmoni i cui tumori hanno un certo cambiamento genetico. Recentemente inoltre, i ricercatori hanno identificato variazioni genetiche che influenzano la risposta delle persone depresse al citalopram (Celexa), una classe ampiamente utilizzata di farmaci antidepressivi chiamati inibitori selettivi della ricaptazione della serotonina (SSRI). Poter analizzare il DNA e identificare la mutazione permette notevoli sviluppi nella medicina di precisione e enormi miglioramenti nella cura dei pazienti attraverso piani terapeutici adatti ad ogni individuo”.
Fino a poco tempo fa, i ricercatori nella realizzazione dei farmaci usavano un approccio che prevedeva lo screening di sostanze chimiche con un’ampia azione contro una malattia. I ricercatori stanno ora utilizzando le informazioni genomiche per trovare o progettare farmaci mirati a sottogruppi di pazienti con profili genetici specifici. L’obiettivo è quello di produrre nuovi farmaci che siano altamente efficaci e non causino gravi effetti collaterali.